Teori Tumbukan
Mengapa kenaikan suhu,
penambahan luas permukaan, peningkatan konsentrasi, dan penambahan
katalis dapat mempengaruhi laju reaksi? Salah satu teori yang dapat
menjelaskannya dikenal dengan nama “teori tumbukan”.
1. Hubungan Faktor-Faktor yang Mempercepat Laju Reaksi dengan Teori Tumbukan
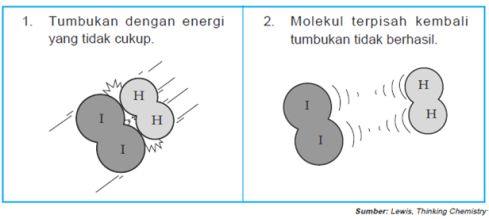
Tumbukan antara pereaksi ada yang menghasilkan reaksi dan tidak,
sebagai contoh amati gambar reaksi antara hidrogen dan iodium berikut:Untuk mengetahui teori tumbukan menjelaskan faktor-faktor yang mempengaruhi laju reaksi, Perhatikan Tabel berikut:
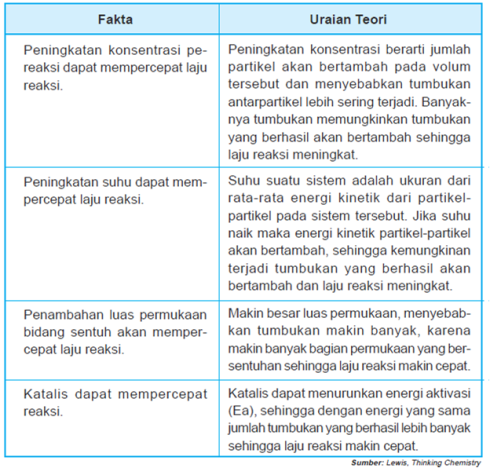
Tabel : Hubungan faktor-faktor yang mempercepat laju reaksi dengan teori tumbukan
Berdasarkan teori tumbukan, suatu
tumbukan akan menghasilkan suatu reaksi jika ada energi yang cukup.
Selain energi, jumlah tumbukan juga berpengaruh. Laju reaksi akan lebih
cepat, jika tumbukan antara partikel yang berhasil lebih banyak terjadi.
2. Energi Aktivasi
Pada kenyataannya molekul-molekul dapat
bereaksi jika terdapat tumbukan dan molekul-molekul mempunyai energi
minimum untuk bereaksi. Energi minimum yang diperlukan untuk bereaksi
pada saat molekul bertumbukan disebut energi aktivasi. Energi aktivasi
digunakan untuk memutuskan ikatan-ikatan pada pereaksi sehingga dapat
membentuk ikatan baru pada hasil reaksi. Misalnya energi aktivasi pada
reaksi gas hidrogen dan iodium dengan persamaan reaksi:
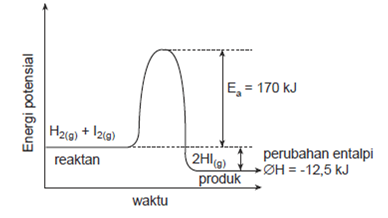
digambarkan pada grafik sebagai berikut.
Energi aktivasi pada reaksi tersebut
adalah 170 kJ per mol. Untuk terjadi tumbukan antara H2 dan I2
diperlukan energi ≥170 kJ. Pada saat reaksi terjadi energi sebesar 170
kJ diserap dan digunakan untuk memutuskan ikatan H – H dan I – I
selanjutnya ikatan H – I terbentuk. Pada saat terbentuk H – I ada energy
yang dilepaskan sehingga reaksi tersebut termasuk reaksi eksoterm.
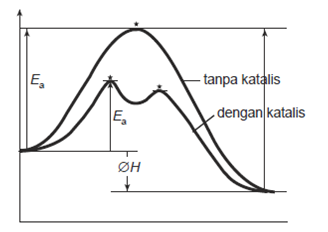
Untuk mengetahui bagaimana kerja katalis sehingga dapat mempercepat reaksi, Perhatikan Gambar berikut:
Pada Gambar diatas, proses reaksi tanpa
katalis digambarkan dengan satu kurva yang tinggi sedangkan dengan
katalis menjadi kurva dengan dua puncak yang rendah sehingga energi
aktivasi pada reaksi dengan katalis lebih rendahdaripada energi aktivasi
pada reaksi tanpa katalis. Berarti secara keseluruhan katalis dapat
menurunkan energi aktivasi dengan cara mengubah jalannya reaksi atau
mekanisme reaksi sehingga reaksi lebih cepat.



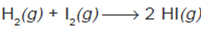
Tidak ada komentar:
Posting Komentar